
biontex轉染常見問題解答
先天免疫系統能夠檢測所謂的“病原體相關分子模式”(PAMP)。這些包括例如細胞外源核酸。取決于細胞類型的“先天免疫系統”有多明顯,它啟動針對假定病原體的防御措施的能力也越大。這導致了K2® 轉染系統和后來的K4® 轉染系統的開發。
使用化學轉染方法,特定細胞類型進行內吞作用和增殖的能力發揮了關鍵作用,因為脂質復合物/復合物最初通過內吞作用逃逸到細胞質中,然后從內體中釋放出來。如果在分裂過程中核膜在短時間內是可滲透的,則脂質復合物/復合物或解復合的 DNA 只能滲透到細胞核(即克服“核屏障”)。如果這兩個過程中的一個以不完善的形式發生,即使轉染方法的應用是最佳的,也可能相應地降低轉染效率。因此,低增殖或無增殖的細胞(如原代細胞或神經細胞)或內吞活性低的細胞(如 Jurkat 細胞)被認為難以轉染也就不足為奇了。另一個關鍵因素是先天免疫系統,它針對每種細胞類型的發展各不相同。細胞能夠檢測外來核酸并進入防御狀態。具有低發育先天免疫系統的細胞(例如 HEK293 細胞)因此易于轉染,而具有強發育免疫系統的細胞(例如 Jurkat 細胞)則難以轉染。
一個加劇的因素是,上面給出的這些現象可能不僅在細胞類型與細胞類型之間*不同,而且在同一細胞類型的不同基因型之間也可能*不同。不同大學甚至同一機構內不同工作組的同名細胞中可能會出現不同的行為,也可以在細胞系的長期傳代過程中觀察到。這種復雜性將協議參數從一個用戶傳輸到另一個用戶的選項減少到最小,即使顯然涉及相同的細胞類型。
不; 每個轉染試劑都有一組特定的屬性,包括:
大腸桿菌的特定組成和比例
每個分子的特定凈載量和 pH 值
聚集體穩定性/脂質復合物穩定性
這些不同的特性對它們與 DNA 和所討論的細胞類型的相互作用有直接和特定的影響。因此,協議參數不能從一種試劑轉移到另一種試劑。
不,這是不可能的。每種細胞類型和每種轉染試劑的高度特異性特性之間的相互作用非常復雜,以致于對轉染效率的預測是徒勞的。另一方面,經驗值表明,例如靜止細胞、懸浮細胞和原代細胞通常難以轉染。但沒有規則無一??例外。
用合成載體系統轉染 DNA 的一個基本原則是,這種材料只能在細胞分裂過程中穿透“核屏障”。作為不可避免的結果,必須遵守以下幾個方面:
細胞培養傳代數不應超過 30 次。每次傳代都會發生一定的遺傳分化;這意味著最能抵抗傳代壓力的細胞將不成比例地增殖。此外,細胞培養基的成分會改變細胞的生理狀態,因為細胞會根據現有的營養條件調整自身。這導致與原始細胞的遺傳差異逐漸擴大。
轉染時細胞應盡可能快地生長。細胞應保持在高增殖狀態,稱為對數期或指數期。通過選擇適合快速增殖的培養基并為要使用的細胞類型和適當的格式創建生長曲線,從而為接種和生長持續時間設置最佳細胞數量,可以最容易地實現這一階段。由于生長抑制,定期保持在匯合條件下的細胞只有在經過幾次傳代后才能恢復其全部生長潛力。

光學匯合與實際匯合不同。上面的生長曲線表示目視確定的匯合(覆蓋整個生長表面)對應于實際匯合(生長曲線的第 5 階段)的程度。這兩個匯合值通常有顯著差異。以圖中所示的 COS7 細胞為例,很明顯,在最常見的情況下,僅實現了早期生長期 3。出于這個原因,如果要在貼壁細胞上執行該過程,作為規則,細胞在轉染當天應具有約 90% 的視覺確定的匯合度。

脂質復合物的形態一方面與陽離子脂質的類型和所用轉染試劑的脂質組成密切相關,另一方面與遺傳物質與轉染試劑的比例密切相關。每種細胞類型都顯示出特定的轉染能力,具體取決于產生的脂質復合物形態
。可以通過應用優化過程確定以下最佳轉染參數:
首先必須確定 DNA/RNA 與脂質的最佳比例。通常認為,脂質復合物需要凈正電荷才能與帶負電荷的細胞膜表面靜電相互作用,以實現成功的內吞吸收。在大多數情況下,這個比例大約為 1-7µl 脂質對 1µg DNA/RNA。
第二個關鍵因素是每個細胞的 lipoplex 量;如果這太高,產生的毒性會過度補償轉染的成功。因此應改變脂質復合物的量以反映已知的 DNA/RNA 與脂質的最佳比例。
陽離子脂質能夠擴散到細胞膜中并使其不穩定。隨著脂質復合物中脂質含量的增加,這可能是毒性增加的主要原因。出于這個原因,與 DNA/RNA 量相關的高水平脂質只能在有限的范圍內使用。
由于未知的原因,脂質復合物對細胞的毒性影響比轉染試劑本身要大得多。
必須假設先天免疫系統在檢測到細胞內的外來核酸后觸發細胞凋亡,這很難與毒性相區分。
這導致了第二個限制:過多的 lipoplex 水平會損害轉染成功。毒性的另一個原因可能是通過表達或抑制的蛋白質本身進行所需的細胞操作,這可能對細胞生理學產生重大影響。在這種情況下,最佳轉染可能會導致高細胞死亡率,這只能通過下調轉染效率來避免。
細胞培養中使用的血清(例如 FCS、FBS)是一種高度復雜的不確定混合物,由水溶性血液成分(如生長因子和營養物質)組成,并且總是對轉染成功有重大影響。
血清具有廣泛的脂質復合物抑制特性。因此,在脂質復合物形成(結合轉染試劑和遺傳物質)期間不得存在血清。
用這些轉染試劑形成的脂質復合物可以與含血清的細胞培養基一起添加到細胞中,而不會影響轉染結果。事實上,當存在血清時,這些試劑會定期提供更高水平的轉染效率。
血清支持細胞生長行為。其成分,如生長激素,可顯著促進待轉染細胞的生長和細胞分裂率,從而顯著提高轉染效率。在選擇合適的細胞培養基時,還應考慮細胞的增殖行為。如果存在多種可能性,則應選擇細胞增殖率最高的培養基。
由于血清的保質期極其有限(最長 1 個月),應注意所用血清在有效期內,因為使用過期血清會顯著損害細胞所需的成分。在這種情況下,細胞顯示出*不同和減少的生長模式(見圖),并且無法再預期最佳轉染結果。
血清的質量可能因批次而異。如果所有其他參數保持不變,成分的多樣性會導致不同的轉染結果。
是的,因為細胞培養物的任何污染,無論是真菌、病毒還是細菌,都會對轉染結果產生重大影響,通常會導致整個細胞培養物死亡。由于支原體污染具有不可見且不會導致細胞死亡的特殊特性,因此污染可能會在很長一段時間內未被發現。然而,這些細菌對轉染成功有廣泛的影響:
由于精氨酸需求增加,細胞生長顯著降低(見圖)
支原體被先天免疫系統識別并調節細胞因子的產生
支原體引起染色體畸變
支原體滯留在細胞膜中并可能調節細胞膜過程,如內吞作用。
有和無支原體污染的 HeLa 細胞的不同細胞生長:

支原體污染對轉染效率的影響:
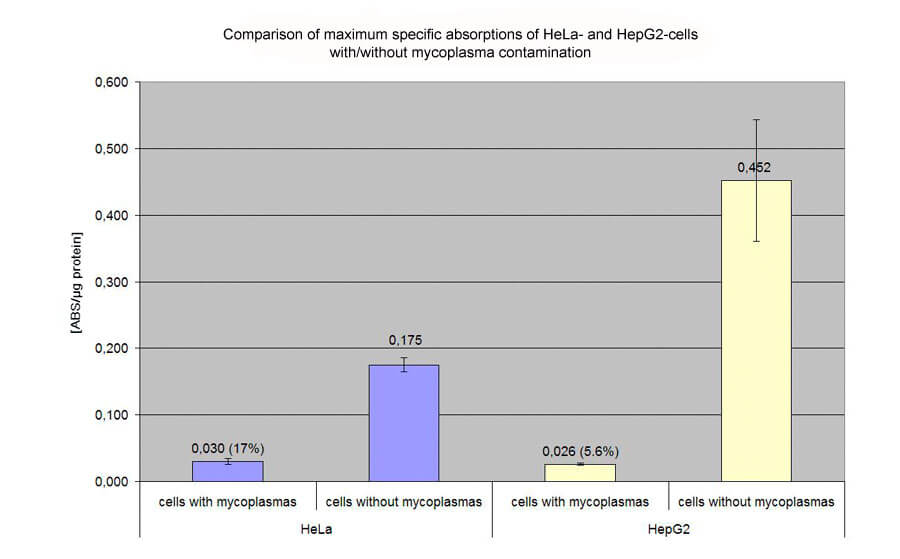
在 48 孔板上用 pCMVßgal 轉染 HeLa 和 HepG2 細胞。通過 ONPG 和 BCA 分析評估比吸收值。下圖顯示了支原體污染對 HeLa 和 HepG2 細胞的廣泛影響(未污染細胞效率的 17% 和 5.6%):
支原體可以在幾乎所有已知的細胞類型中增殖,因此無處不在。據估計,大約 80% 的日本細胞培養物、65% 的阿根廷細胞培養物和 15% 的美國細胞培養物被支原體污染。主要來源是實驗室工作人員以及胰蛋白酶和血清,它們是從動物來源分離的細胞培養添加劑。
一種長期存在的支原體檢測方法是 DAPI 染色。然而,由于其極低的檢測靈敏度,該方法僅顯示出顯著水平的污染。PCR 方法明顯更靈敏,因此是檢測方法。Biontex 提供基于 PCR 的檢測試劑盒MycoSPY®和MycoSPY® Master Mix,它們甚至可以識別支原體基因組的單個拷貝。如果細胞培養物受到污染,我們建議使用MycoRAZOR®進行處理。
基本上,具有更高純度的遺傳材料將始終提供更好的轉染結果。需要特別注意的一個因素是被稱為內毒素的脂多糖污染。它們在制造過程中由細菌引入,即使以微量存在,也會被先天免疫系統檢測到,從而顯著損害轉染過程。應注意遺傳材料的清潔包括去除內毒素,可提供商業試劑盒。不建議將基于“小量制備方案”的質粒清洗用于轉染目的,因為遺傳物質的特定結構直接影響轉染成功:
由于啟動子具有特定的表達率,因此細胞具有特征量或每單位時間的表達產物量。
根據細胞類型,待表達基因或產生的蛋白質的特定特征可能顯著影響細胞的生理學,甚至導致細胞死亡。
遺傳物質的尺寸和三級結構也會影響潛在的轉染成功。一般來說,以下原則適用:
細胞的轉染能力隨遺傳物質的量而下降
超螺旋質粒在瞬時轉染中更有效,而線性 DNA 更適合于穩定轉染。
Lipoplexes 粘附在細胞培養容器的自由塑料表面上,因此在轉染過程中丟失。這就是為什么不能簡單地將針對特定容器格式確定的最佳參數與其他容器格式成比例地應用的原因。
使用的容器規格越小,lipoplex 的量/mm² 就必須越高。當從 6 孔培養皿縮小到 96 孔格式時,必須使用大約三倍于 lipoplex / cm² 的量才能實現可比的轉染效率。
不。鑒于常見問題解答中給出的大量參數是成功轉染的影響因素,很明顯,提供通用的特定協議是徒勞的。我們網站上列出的已發表案例研究只能說明如何盡快實現成功轉染,一般不能聲稱具有普遍適用性。最后可能需要在自己的實驗室環境中進行優化。
在室溫或 4°C 下長期儲存期間,脂質體制劑往往會凝結。這意味著大小分布向更大的脂質體移動,這可能對轉染效率產生負面影響。冷凍和解凍脂質是一種已知的生產脂質體的方法,因此也可用于為某些轉染試劑重建理想的脂質體大小分布。
為此目的,該試劑在冰箱中冷凍,然后在室溫下解凍。軟渦旋后,試劑再次儲存在 4°C。建議在使用 METAFECTENE 轉染試劑系列(METAFECTENE®、METAFECTENE® PRO、METAFECTENE® SI)和K2® 轉染試劑/ K4® 轉染試劑,兩個月后。
電話
QQ咨詢
4006551678